Accueil / Actualités / Actu-Diéta
20e Journée d’étude | 22/02/2024 | Lumière sur la santé intestinale
Syndrome de l'intestin irritable et efficacité d'un régime pauvre en FODMAP
- Jo Mons
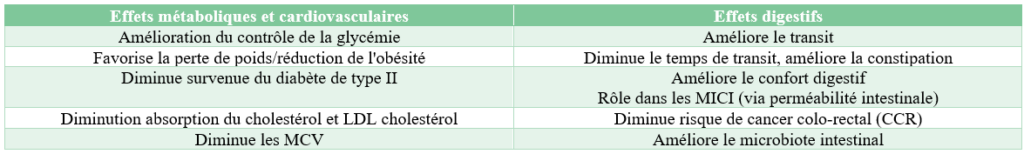
Le consensus belge sur le Syndrome de l’Intestin Irritable (SII) stipule que l’efficacité du régime pauvre en FODMAP dans le traitement des symptômes du SII est bien établie (1). Les études soulignent qu’il devrait être considéré comme une intervention soutenue et dirigée par un·e diététicien·ne spécialisé·e.
Jo Mons, diététicienne agréée, professeur en nutrition et diététique à Odisee Gand, et diététicienne indépendante,
certifiée par la Monash University pour le régime Low FODMAP.
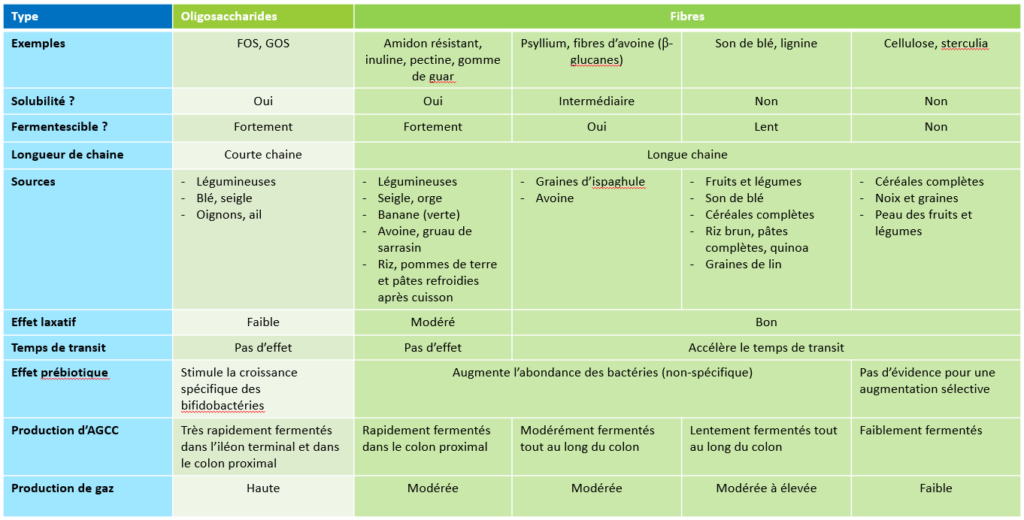
Le syndrome de l’intestin irritable est un trouble fonctionnel du système digestif, dont le diagnostic clinique repose sur les critères de Rome IV, publiés en 2016 (2). Ce trouble, qui peut avoir un impact négatif sur la qualité de vie des patients, est considéré comme un “désordre de l’interaction entre le cerveau et l’intestin”. D’après plusieurs méta-analyses et revues de la littérature (Bardacke, 2023 ; Van Lanen, 2021), le régime pauvre en FODMAP (Fermentable Oligo-, Di-, Mono-saccharides And Polyols) diminue les symptômes généraux et augmente la qualité de vie des personnes atteintes du syndrome de l’intestin irritable. Toutefois, il est important de souligner que ce régime nécessite un accompagnement personnalisé par un·e diététicien·ne avec une expertise particulière en matière de troubles gastro-intestinaux et de connaissances des FODMAPs (McKenzie, 2016; O’Keeffe, 2017; Van Ouytsel, 2021).
En Flandre, il existe un réseau de diététicien·ne·s spécialisé·e·s dans le régime pauvre en FODMAP (https://www.fodmapp.be/fodmap-dietisten/). Ces professionnel·le·s qui ont suivi une formation de base et une masterclass (organisées par des diététiciennes certifiées FODMAP par Monash : Jo Mons et Ann Parmentier) renforcent leurs compétences en se formant régulièrement et en prenant part à au moins une formation sur ce sujet chaque année.

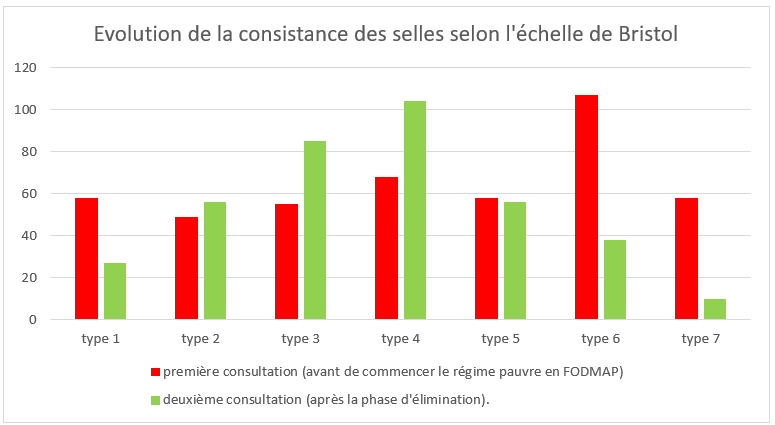
En plus, ce groupe a évalué l’efficacité d’un régime pauvre en FODMAP (LFD – Low Fodmap Diet) pour les patients souffrant de SII (8). 232 patients présentant un SII et susceptibles de bénéficier d’un LFD ont été suivis. Ces diététicien·ne·s ont effectué une évaluation nutritionnelle complète, ont adapté les recommandations théoriques en conseils diététiques pratiques et actualisés et ont fourni une éducation détaillée. Ils ont donné des listes d’aliments appropriés, élaboré un plan nutritionnel personnalisé, proposé des recettes adaptées et indiqué des produits disponibles dans les magasins d’alimentation locaux. Pour évaluer l’évolution de leurs symptômes, tous les patients ont complété un questionnaire basé sur l’IBS-SSS (Irritable Bowel Syndrome Severity Scoring System) et l’IBS-QOL (Irritable Bowel Syndrome Quality of Life) lors de leur première consultation (avant de commencer le LFD) et lors de la deuxième consultation (après la phase d’élimination). Le soulagement des symptômes a été mesuré à l’aide d’une échelle visuelle analogique (EVA) allant de 0 à 100 points, permettant une évaluation précise de la sévérité des symptômes rapportés par les patients. Par ailleurs, les changements de la fréquence et de la consistance des selles ont été évalués en utilisant l’échelle de Bristol (Bristol Stool Chart Scale, BSCS).
L’âge moyen des participants était de 39 ans et 81 % des participants étaient des femmes (fig 1).
La Figure 2 montre le soulagement des symptômes basé sur l’échelle visuelle analogique : les douleurs abdominales, les ballonnements, les flatulences, les borborygmes, le besoin de déféquer et la fatigue étaient nettement moins importants après la phase d’élimination. En plus, les douleurs abdominales sont passées de six à deux jours sur dix. Aussi l’influence négative sur la qualité de vie a nettement diminué.
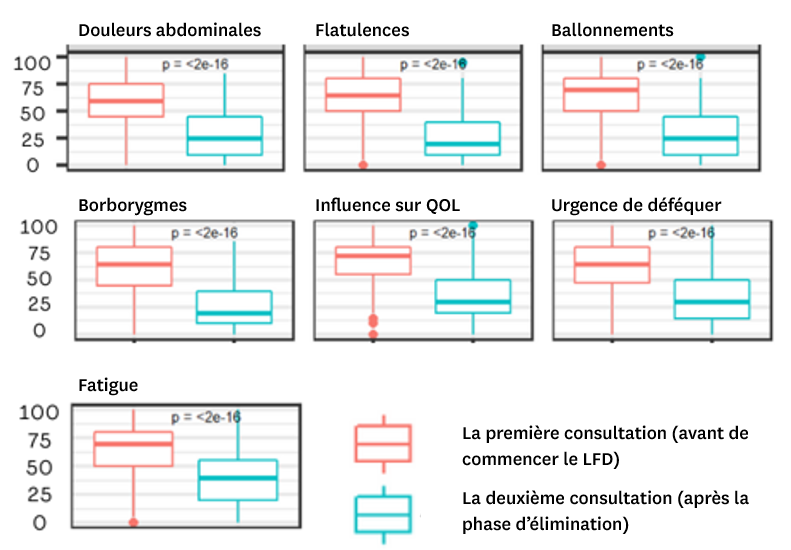
Le pourcentage de patients ayant une fréquence de selles supérieure à 4 fois par jour est passé de 25 à 6,9 %. Une amélioration a été observée dans les catégories de la consistance des selles selon l’échelle de Bristol : 71 % versus 20,7 % pour les types 6-7 et 46,1 % versus 35,8 % pour les types 1-2 lors de la première consultation (avant de commencer le LFD) et lors de la deuxième consultation (après la phase d’élimination) (fig. 3-4).

Enfin, 83,9 pourcents des patients évaluent le régime pauvre en FODMAPs comme efficace avec une diminution claire de leurs symptômes.
Cette étude valide l’efficacité du régime pauvre en FODMAP, accompagné par un·e diététicien·ne spécialisé·e, pour atténuer les symptômes du Syndrome de l’Intestin Irritable chez les patients suivis en soins de première ligne.
Références :
1/ Kindt, S., Louis, H., Deschepper, H., Arts, J., Caenepeel, P., De Looze, D., Gerkens, A., Holvoet, T., Latour, P., Mahler, T., Mokaddem, F., Nullens, S., Piessevaux, H., Poortmans, P. J., Rasschaert, G., Surmont, M., Vafa, H., Van Malderen, K., Vanuytsel, T., . . . Tack, J. (2022). Belgian consensus on irritable bowel syndrome. Acta Gastro-enterologica Belgica, 85(2), 360–382. doi.org/10.51821/85.2.10100
2/ Drossman, D. A., & Hasler, W. L. (2016). Rome IV—Functional GI Disorders: Disorders of Gut-Brain Interaction. Gastroenterology, 150(6), 1257–1261. doi.org/10.1053/j.gastro.2016.03.035V
3/ Van Lanen, A. S., De Bree, A., & Greyling, A. (2021). Efficacy of a low-FODMAP diet in adult irritable bowel syndrome: a systematic review and meta-analysis. European Journal Of Nutrition. doi.org/10.1007/s00394-020-02473-0
4/ Bardacke, J. A., Yarrow, L., & Rosenkranz, S. K. (2023). The Long-Term Effects of a Low–Fermentable Oligosaccharides, Disaccharides, Monosaccharides, and Polyols Diet for Irritable Bowel Syndrome Management. Current Developments in Nutrition, 7(10), 101997. doi.org/10.1016/j.cdnut.2023.101997
5/ O’Keeffe, M., & Lomer, M. (2017). Who should deliver the low FODMAP diet and what educational methods are optimal: a review. Journal Of Gastroenterology And Hepatology, 32(S1), 23–26. doi.org/10.1111/jgh.13690
6/ McKenzie, Y., Bowyer, R. K., Leach, H. J., Gulia, P., Horobin, J., O’Sullivan, N., Pettitt, C., Reeves, L., Seamark, L., Williams, M. J., Thompson, J., & Lomer, M. (2016). British Dietetic Association systematic review and evidence‐based practice guidelines for the dietary management of irritable bowel syndrome in adults (2016 update). Journal Of Human Nutrition And Dietetics, 29(5), 549–575. doi.org/10.1111/jhn.1238
7/ McKenzie, Y.A.; Bowyer, R.K.; Leach, H.; Gulia, P.; Horobin, J.; O’Sullivan, N.A.; Pettitt, C.; Reeves, L.B.; Seamark, L.; Williams, M.; et al. British Dietetic Association systematic review and evidence-based practice guidelines for the dietary management of irritable bowel syndrome in adults (2016 update). J. Hum. Nutr. Diet. 2016, 29, 549–575. doi.org/10.1111/jhn.12385
8/ Van Ouytsel, P., Szalai, A., Van Gossum, A., Arvanitakis, M., & Louis, H. (2021). Feasibility of a low FODMAPs diet without initial dietician intervention in the management of patients with irritable bowel syndrome: a prospective study. Acta Gastro-enterologica Belgica, 84(4), 593–600. doi.org/10.51821/84.4.010
9/ Mons, J., Parmentier, A.(2023, octobre). Effectiveness of a dietitian supported low FODMAP diet in primary care patients with IBS in Belgium. Poster presented at Gastrodiet 2023 Evolution and revolution of the Monash University, Prato.
Les actualités
Partageons nos connaissances.